UDI(医疗器械唯一标识码)解读
发布时间:2023-05-23来源:长春艾迪尔医用科技发展有限公司
一、UDI法规基础介绍
中国UDI的“基本法”是《医疗器械唯一标识系统规则》,这个规则是2019年8月发布的。其基本目的是为了贯彻落实《国务院办公厅关于印发治理高值医用耗材改革方案的通知》(国办发〔2019〕37号),规范医疗器械唯一标识系统建设,加强医疗器械全生命周期管理。
首先回顾一下中国医疗器械UDI实施的一些关键时间点:
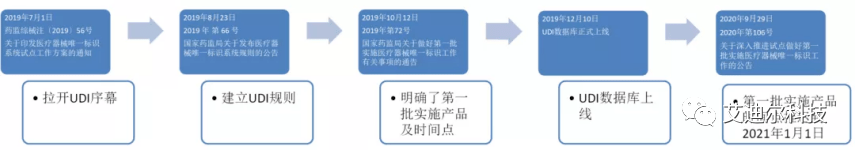
2019年7月——【药监综械注〔2019〕56号】 关于印发医疗器械唯一标识系统试点工作方案的通知: 拉开了中国UDI的序幕 ;
2019年8月——【2019年第66号】国家药监局关于发布医疗器械唯一标识系统规则的公告: 中国UDI的规则被正式建立 ;
2019年10月——【2019年第72号】国家药监局关于做好第一批实施医疗器械唯一标识工作有关事项的通告:明确了第一批实施产品及其时间点;
2019年12月—— UDI数据库正式上线 ;
2020年9月——【2020年第106号】关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告: 第一批实施产品时间点推迟到2021年1月1日 。
二、什么是UDI?
唯一器械标识(Unique Device Identification,缩写UDI),医疗器械唯一标识是指呈现在医疗器械产品或者包装上的由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。
UDI可以被看作医疗器械产品在供应链中的唯一“身份证”, 应包括产品标识和生产标识。产品标识为识别注册人/备案人、医疗器械型号规格和包装的唯一代码;生产标识由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。
三、什么是UDI数据载体?
UDI数据载体,是 指存储或者传输医疗器械唯一标识的数据媒介 , 其应当满足自动识别和数据采集技术以及人工识读的要求,通俗来说就要包括两部分:一部分是 机器可读 ,其形式可以为 一维码、二维码或者射频标签 ;另外一部分是 人工可读 ,即应为数字和/或字母的形式。

四、什么是UDI数据库?
UDI数据库,是 指储存 医疗器械唯一标识的 产品标识 与 关联信息 的 数据库 。与美国的GUDID系统和欧盟的UDI数据库类似,该数据库对公众开放,供公众查询。药监局负责建立及维护该数据库; 注册人 /备案人 应在产品上市销售前,将产品标识(DI)及相关数据上传至该数据库 ,并 维护更新相关数据 。
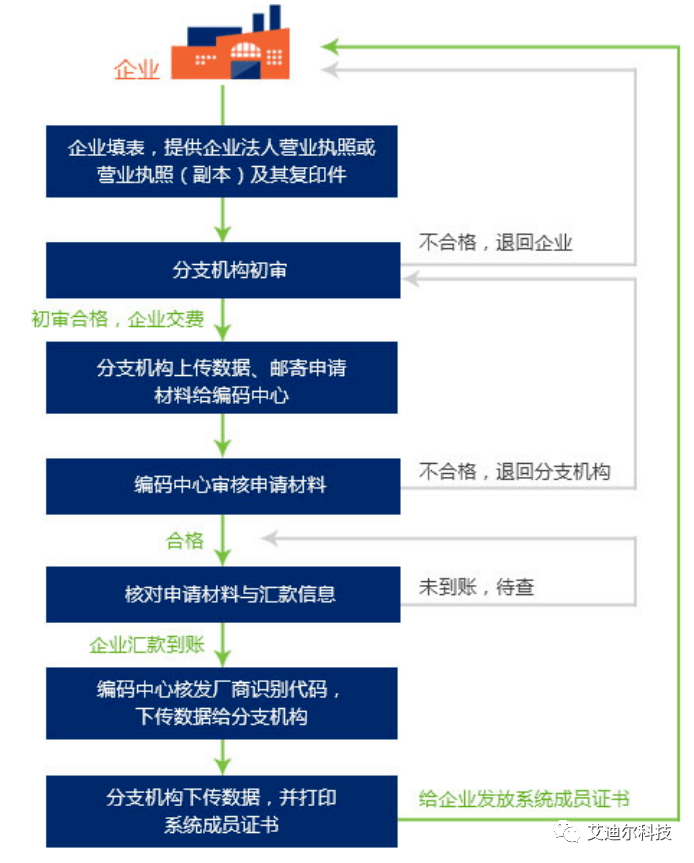
五、发码机构是什么?中国有哪些认可的发码机构?
器械唯一标识的发码机构应当为中国境内的法人机构 ,具备完善的管理制度和运行体系,确保按照其标准创建的医疗器械唯一标识的唯一性,并符合我国数据安全有关要求。
发码机构应当向注册人/备案人提供执行其标准的流程并指导实施,为便于注册人/备案人等掌握发码机构的编码标准,供相关方选择或应用,发码机构应当将其编码标准上传至医疗器械唯一标识数据库并动态维护。
目前中国认可的发码机构有三家:

六、UDI实施准备
熟悉UDI的基本法《规则》、持续跟踪UDI的相关法规:
就目前来说,监管部门只公布了第一批UDI实施目录和实施时间,当前目录中涵盖的是III类高风险器械,包括:有源手术器械、无源手术器械、神经和心血管手术器械、医用成像器械、输血、透析和体外循环器械、有源植入器械、无源植入器械、注输、护理和防护器械、眼科器械等共9大类产品,具体产品类别见国家药监局/国家卫生健康委/国家医保局公告(2020年 第106号),实施时间为2021年1月1日。
熟悉UDI相关标准:
与UDI相关的标准,主要包括:

选择合适的发码机构:
如果只考虑中国市场,我们可以选择前文中三家发码机构中的任何一家。但由于不少器械的销售市场不仅仅局限于国内。在这种情况下,我们发码机构的选择就要兼顾到海外监管部门的要求(美国、欧盟)。
下表是目前欧盟和美国监管部门认可的发码机构。
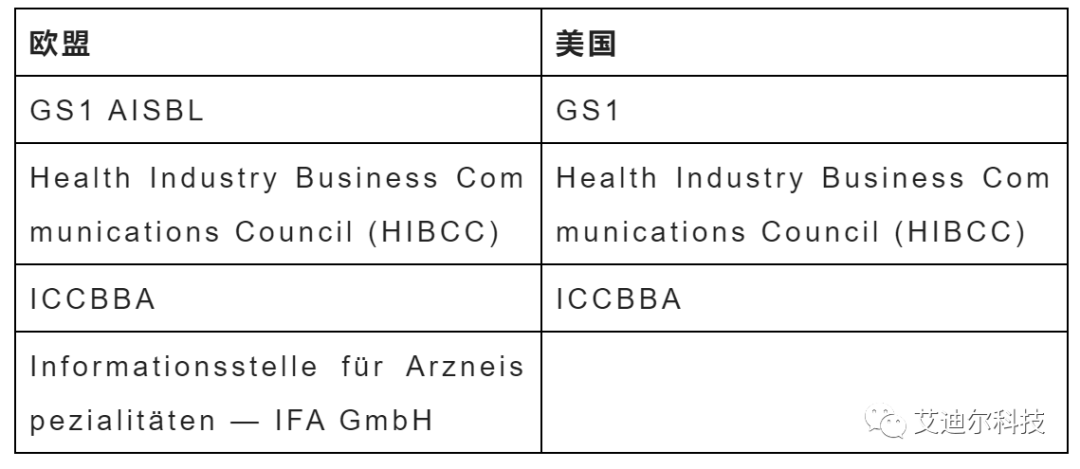
由此我们可以看出,只有GS1一家机构能同时满足中国、欧盟和美国的要求。(下文如果没有特别说明,就以GS1来举例)
申请注册人备案人识别代码
注册人备案人识别代码通常有7~10位数字组成,这个代码可追溯到某个特定注册人备案人。注册人备案人代码前三位是前缀码,国际物品编码协会已经分配给中国GS1的前缀码为690-699。我们在申请的时候可以参考GS1的官网,在GS1的官网上面给了比较清楚的步骤,如下:
确定UDI的组成:
我们之前已经了解到:医疗器械唯一标识包括产品标识和生产标识, 即UDI=产品标识(DI)+生产标识(PI)。
UDI的结构示意图如下(摘自YY/T 1630-2018 附录A):
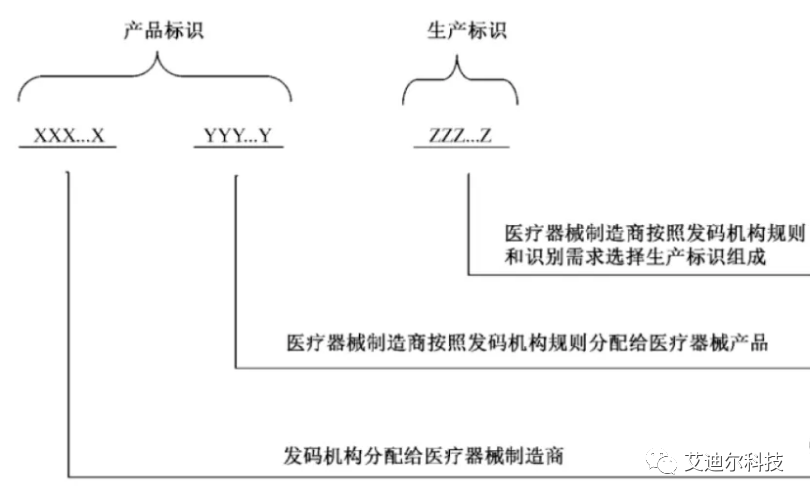
上面的产品标识和生产标示只是一个示意图,DI和PI可以是串联,也可以并联的。下面是两个不同厂家的UDI示例,供参考。


UDI规则和GS1的标准的对应关系如下:
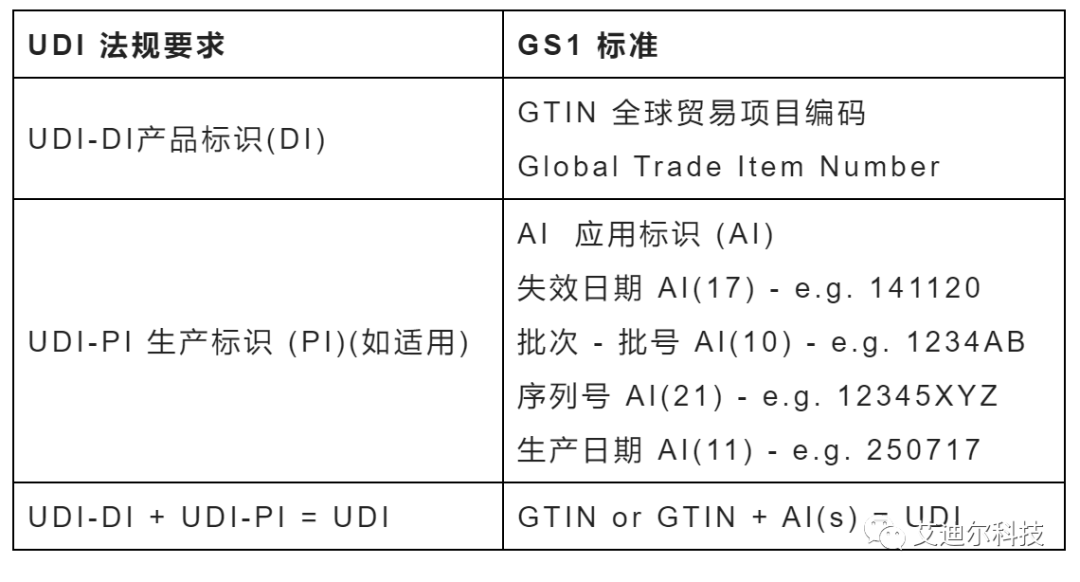
产品标识UDI-DI:
UDI-DI是一个静态信息,用来指明供应链中某个医疗器械的身份信息。在中国,GB 12904中规定了商品条码即GTIN的表示方法。对于医疗器械,最常见的表示方法为GTIN-14,下面我们就以GTIN-14来举例:

上图GTIN-14的第一位(D1)为指示位(indicator),用来指示不同的包装等级;剩下的第2到第13位(D2 - D13)分别包括注册人备案人识别代码、商品项目代码;最后一位(D14)为校验码。
注册人备案人识别代码 由7-10位数字组成,由中国编码中心负责分配和管理。注册人备案人识别的前3位为前缀码,前缀码由国际物品编码协会分配给中国。
商品代码由5-2位数字组成,一般注册人备案人可自行编制。
校验码有1位数字,用于检验整个编码的正误。校验码可以自行计算,其方法可以参考标准GB12904-2008的附录B。从实操角度来说,目前很多编码软件能自动计算产生。
生产标识 UDI-PI:
UDI-PI对应于GS1标准来讲即为应用标识符。它是一个动态信息,其内容通常为序列号、批号、生产日期和有效期(失效日期)等;它属于某个特定医疗器械的动态附加信息,可以跟踪到具体的产品或者批次。
根据《GB/T 16986-2018 商品条码 应用标识符 》,应用标识符常见格式如下:

建议医疗器械厂家根据自己的实际情况(以满足追溯的要求)来确定产品的生产标识信息。例如:
1、对于要求追溯到批次的器械,由DI联合PI中的生产日期/有效期、批号实现。
2、对于要求追溯到单品的医疗器械,由DI联合PI中的生产日期/有效期、序列号实现。
七、UDI标签生成
在产品完成GTIN(UDI-DI)分配,同时确定了产品的生产标识 UDI-PI后,下一步的动作就是生成UDI标签。按照中国法规的要求,UDI应包括两个部分:
(1)机器可读码,目前最为常见的形式就是一维码和(或)二维码。(注册人备案人可以根据自己的产品实际情况选择合适的UDI载体)。
(2)人工可读,即为数字和字母组合。
怎么产生一维码、二维码?现在市面上有很多现成软件能自动产生一维码、二维码,也有很多这方面的厂家提供服务,可以基于自己的实际情况去选择适合自己的方法。
在生成完一维码、二维码后,注册人备案人需要对现有标签进行标签变更。之后就可以完成UDI标签打印及UDI标签的检验,标签检验的目的就是保证UDI可以在整个流通领域的可读性。
在完成上面的动作后,我们是否就能满足中国UDI的要求?是否就能把UDI标签贴在产品上去上市流通了呢?当然不是。
八、UDI数据上传
产品要上市流通,还要完成下面的环节:
(1)注册人备案人应当在申请医疗器械注册 、 注册变更或者办理备案时 , 在注册/备案管理系统中提交其产品标识 (UDI-DI)。注意:产品在UDI实施日前,已生产销售的医疗器械可不具备医疗器械唯一(UDI)标识。
(2)注册人备案人在销售产品之前 ,应确保产品标识和相关数据上传至中国医疗器械唯一标识数据库(UDID) 。同样的这也是针对已经实施UDI的产品,对尚未列入实施目录的产品不强制要求。
相关数据是什么?相关数据包括哪些内容?请参考标准《YY/T 1752-2020 医疗器械唯一标识数据库基本数据集》。里面对于每个数据集都有相关的解释。
怎么填报呢?请参考标准《YY/T 1753-2020 医疗器械唯一标识数据库填报指南》。具体操作可以通过国家药品监督管理局网上办事大厅实现系统登录操作。
完成以上的动作,可以认为该医疗器械已经能满足中国UDI的最基本要求。
-------------------------------------------------------------------
医疗器械规范化、专业化是大势所趋,长春艾迪尔拥有专业的注册、报批、技术团队,对产品质量严格把关,致力于医疗器械的研发生产,独家专利导尿管、混药器、内窥镜、雾化吸入器、扩张器等多项专利产品被纳入第三批UDI名单,涉及领域广泛,期待与您合作。
联系电话:0431-81101798
- 上一个:企业质量安全管理机制
- 下一个:


